Q)TPP和CQAs得出CPPs◆◆◆■,得到对目标过程的定义,再结合相关技术去建立设计空间和控制整个过程,按照既定的目标设计出合格的产品。
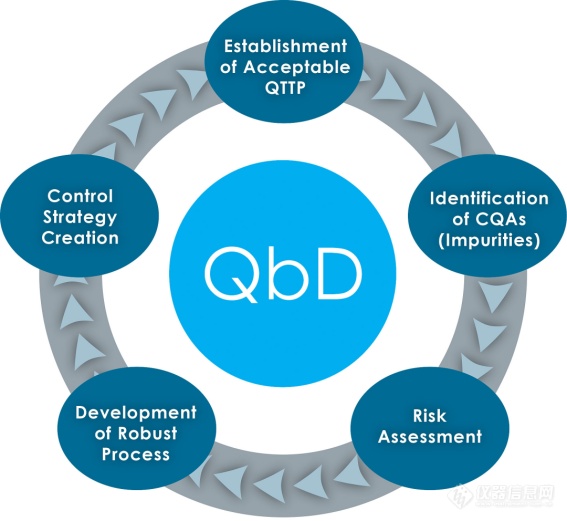
以预先设定的目标产品质量特性作为研发起点,在了解关键物质属性的基础上,通过试验设计★★,研究产品的关键质量属性,确立关键工艺参数★◆。在多影响因素下,建立能满足产品性能且工艺稳健的设计空间(Design Space)■■■。并根据设计空间★■★★◆◆,建立质量风险管理,确立质量控制策略和药品质量体系;
实施QbD是将PAT过程分析技术与风险管理综合应用于药品工艺开发的过程,它的目的不是消灭生产过程中的偏差,而是建立一种可以在一定范围内调节偏差来保证产品质量稳定性的生产工艺;
PAT工具◆◆★★★■,对冻干过程中所有的关键工艺参数(关键过程参数CPsP和关键产品参数CPtP进行实时在线的监测和控制),建立设计空间,确定边界值及合理且优化的工艺空间。
诊断试剂和制药领域的LyoBead技术◆◆■★■★:Why◆■■■◆, How★★■★◆★, What■■★◆?
基于QbD理念进行冻干工艺设计和优化,用CQA/QTPP/CPP来识别关键和非关键阶段以及每个阶段的相对风险。用“约束理论★◆★”识别*风险点(主干燥),提供*风险的解决方案★◆,并将其它风险一起控制。对冻干配方、设备和工艺进行深入的理解和控制,*按照即定的工艺目标设计并生产出合格且*的产品,并将风险降至*。这就是QbD所追求的!
中国石油集团渤海石油装备制造有限公司辽河热采机械制造分公司200.00万元采购磁粉探伤仪,X射线探伤◆◆★★...
PAT ICH Q8/Q9/Q10准则对QbD的规范法案中可以看出,产品与过程的性能特征都需要经过科学设计以满足特定目标◆◆■■★■,而不是凭经验从实验中推导。
珂睿科技参加上海慕尼黑分析生化展:Leo、Sco系列新一代UHPLC,感受智慧分析的无限可能
![]()
是cGMP的基本组成部分◆■◆◆★,是科学的■◆◆■,基于风险的全面主动的药物开发方法,从产品概念到工业化均精心设计★■★■■,是对产品属性★★、生产工艺与产品性能之间关系的透彻理解;
FDA在2004年Pharmaceutical cGMP for 21st-A Risk Based Approach报告中正式提出了QbD的概念,并且被人用药品注册规定国际协调会议(ICH)纳入质量体系当中。在ICH质量体系框图中,明确提出了要求达到理想的质量控制状态,必须从药物研发以及质量源于设计、质量风险管理以及药物质量体系三方面入手,即Q8,Q9和Q10的结合★■■★★;其中Q8中明确说明质量不是通过检验注入到产品中,而是通过设计赋予的。
![]()
随着具有潜在疗效的生物分子数量不断增加,对了解这些生物分子结构复杂性和稳定性的需求也在与日俱增。相对于其它干燥技术,冷冻干燥依然是*的稳定的技术,原因很简单:它是一个低温的过程★★★■◆◆,可以用于处理生物溶液而使其免遭破坏,提高药物制剂的稳定性和货架期。然而,冷冻干燥又是一个复杂的过程■■◆■★,如果设计不当■◆◆★★,容易在处理过程与储存过程中产生不稳定性◆◆。
钢研纳克成果入选市场监管总局“计量促进新质生产力发展”优秀案例和典型案例
指南Q8、Q9、Q10要求。FDA及GMP近年来也强烈建议遵循QbD理念,以*程度上保证产品质量,减少和控制风险。
江苏省苏力环境科技有限责任公司192★★★■■★.45万元采购搅拌器★◆★■◆,液液萃取仪,快速溶剂萃取,气体采样器◆■■★★■,气体...
德祥邀您参加BioCon China Expo 2022,共论生物医药发展之路


 客服1
客服1